3.1.1 Energieumwandlung
Erscheinungsformen der Energie
Chemische Reaktionen sind immer auch mit einem Energieumsatz verbunden. Gleichzeitig kommt es zu einer Umwandlung von einer Energieform in eine andere. Energie tritt in unterschiedlichsten Erscheinungsformen auf. Bei allen Energieumwandlungen gilt bekanntermaßen der Energieerhaltungssatz. Es geht also weder Energie verloren, noch wird Energie neu erschaffen.
Die wichtigsten Erscheinungsformen, die im Zusammenhang mit chemischen Reaktionen auftreten, sind:
Chemische Energie: Es handelt sich um die Energie, die in chemischen Stoffen, genauer: in deren chemischen Bindungen enthalten ist.
Wärmeenergie: Sie wird z.B. bei Verbrennungen frei.
Licht: Es wird ebenfalls oft bei Verbrennungen frei: Kerzenlicht.
Schall: Er tritt etwa bei Explosionen auf.
Elektrische Energie: Sie wird eingesetzt bei Elektrolysen, also bei der Zerlegung eines Stoffes mit Hilfe des elektrischen Stroms. Umgekehrt liefert eine Batterie elektrische Energie.
Volumenarbeit: Entsteht bei einer Reaktion unter atmosphärischem Druck ein Gas aus einer Flüssigkeit oder einem Feststoff, so ist damit eine Volumenvergrößerung verbunden. Das sich ausbreitende Gas muss die umgebende Luft verdrängen. Dabei wird Arbeit verrichtet.
Energieumwandlungen unter Beteiligung chemischer Energie
Die meisten chemischen Reaktionen, die uns im Alltag begegnen, liefern Wärmeenergie. So erzeugen wir die Wärme zum Heizen unserer Häuser häufig durch das Verbrennen von Öl, Gas oder Kohle. Chemisch lässt sich die Verbrennung von Erdgas, das etwa zu 99% aus Methan besteht, durch eine Reaktionsgleichung folgendermaßen formulieren:
CH4 + 2 O2 → CO2 + 2 H2O
Kohle (vereinfachend wird reiner Kohlenstoff angenommen) verbrennt nach der Reaktionsgleichung:
C + O2 → CO2
Beim Autofahren werden verschiedene Kohlenwasserstoffe verbrannt. Als Beispiel sei das Heptan genannt:
C7H16 + 11 O2 → 7 CO2 + 8 H2O
Neben der frei werdenden Wärme wird insbesondere die Energie der sich ausdehnenden Gase in die Bewegungsenergie des Kolbens umgesetzt.
Bekannt ist die zerstörerische Wirkung von explodierenden Sprengstoffen. Hier kommt es ähnlich wie im Verbrennungsmotor zu einer extrem schnell verlaufenden Reaktion, bei der aus einer Flüssigkeit oder einem Feststoff große Mengen an Gasen freigesetzt werden. Als Beispiel sei die Explosion von Nitroglyzerin, wie es im Dynamit enthalten ist, angeführt, bei der aus einem halben Liter einer sich zersetzenden Flüssigkeit (l bedeutet liquid, also flüssig) etwa 600 Liter der Gase Stickstoff, Sauerstoff, Kohlenstoffdioxid und Wasserdampf entstehen (g steht für gasförmig):
4 C3H5 (NO3)3(l) → 6 N2(g) + O2(g) + 12 CO2(g) + 10 H2O(g)
By Niko Lang – Own work, CC BY-SA 2.5, Link
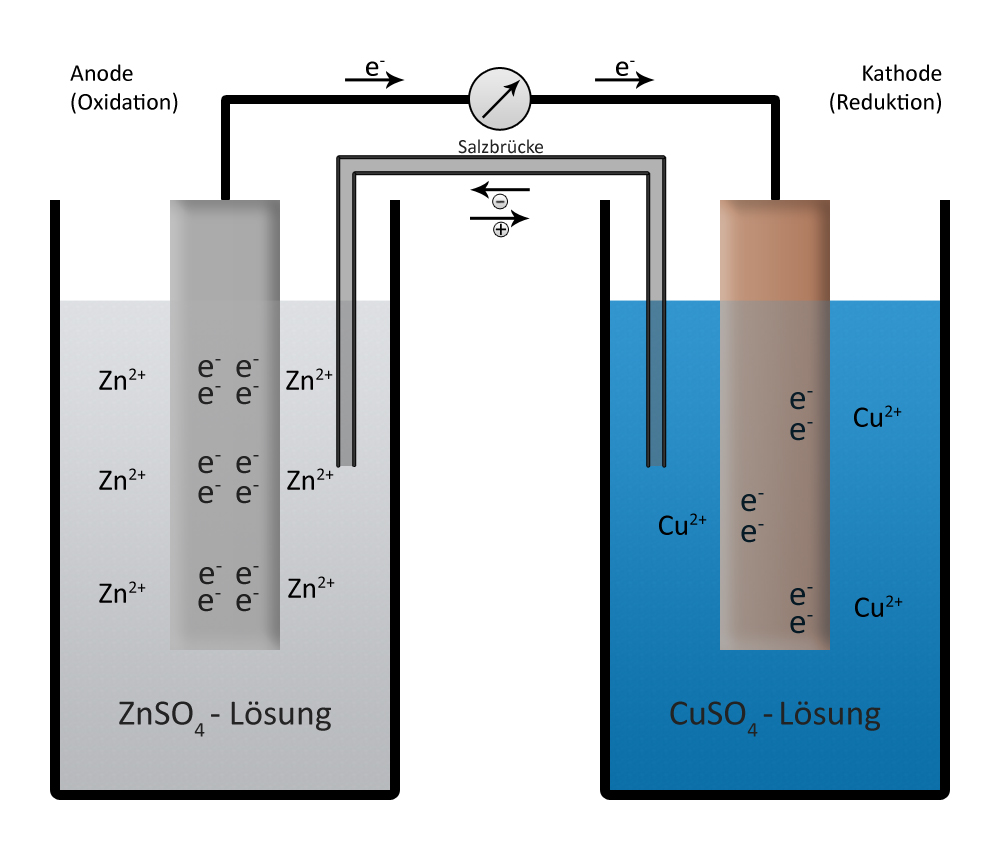
Chemische Energie lässt sich aber auch direkt in elektrische Energie umwandeln, wie dies in allen Batterien geschieht. Am Beispiel des Daniell-Elements ist die Funktionsweise dargestellt. Diese galvanische Zelle ist nach dem englischen Chemiker John Daniell benannt. Der Zinkstab löst sich dabei auf. Zink-Atome treten als Zink-Ionen in die Lösung. Dabei lassen sie zwei Elektronen im Zinkstab zurück. Der Zinkstab wird also negativ aufgeladen:
Zn → Zn2+ + 2 e–
Kupfer-Ionen der blauen Kupfersulfatlösung scheiden sich unter Aufnahme von zwei Elektronen als Kupferatome am Kupferstab ab. Dem Kupferstab werden dadurch Elektronen entzogen. Er lädt sich positiv auf:
Cu2+ + 2 e– → Cu
Die Gesamtreaktion ist damit:
Zn + Cu2+ → Zn2+ + Cu
Elektronen (Strom) fließt also vom Zinkstab über einen äußeren Leiter zum Kupferstab. Damit wird elektrische Energie transportiert, die sich z.B. in einer Glühbirne nutzen lässt. Der Tonbehälter verhindert ein Durchmischen der Salzlösungen, erlaubt aber auch gleichzeitig einen Ladungsausgleich zwischen den Lösungen. Denn in der Zinksulfatlösung nähme sonst die positive Ladung zu, in der Kupfersulfatlösung nähme sie ab. Ohne die Möglichkeit zum Ladungsausgleich kämen die Vorgänge sofort zum Stillstand. So diffundieren Sulfat-Ionen von der Zink-Halbzelle in die Kupfer-Halbzelle. (Ausführlich wird die Funktionsweise einer galvanischen Zelle in der Lehreinheit Elektrochemie besprochen.)
Das Daniell-Element ist ohne praktische Bedeutung. Anders ist dies bei der Zink-Kohle-Batterie („Leclanché-Element“) oder bei den aufladbaren Batterien (Akkus), wie dem Bleiakku („Autobatterie“), den Nickel-Cadmiumakkus oder den Lithiumionen-Akkus etc., wie sie etwa in Handys verwendet werden.
Endotherme und Exotherme Reaktionen
a) Enthalpiebegriff
In der Chemie spricht man häufig von der Enthalpie oder Enthalpieänderung statt von Energie oder Energieänderung. Hintergrund ist folgender: Die in den Stoffen steckende chemische Energie (innere Energie U) tritt bei Reaktionen überwiegend als Reaktionswärme auf. Es handelt sich also um die Differenz der inneren Energie der Stoffe vor und nach der Reaktion (DU). Voraussetzung ist allerdings, dass keine Volumenarbeit geleistet werden muss, das Volumen also konstant bleibt.
Werden bei der Reaktion Gase freigesetzt, muss Volumenarbeit geleistet werden. Die Reaktionswärme bei konstantem Druck wird als Reaktionsenthalpie (DH) bezeichnet. DU und DH unterscheiden sich also um die verrichtete bzw. aufgenommene Volumenarbeit.
Es ist nicht möglich, die innere Energie U oder die Enthalpie H absolut zu bestimmen. Es lassen sich lediglich die bei Reaktionen auftretenden Energieänderungen messen.
b) Energiediagramme und Aktivierungsenergie
Energiediagramme stellen die Enthalpieänderungen im Verlauf einer chemischen Reaktion dar. Sie vergleichen die Enthalpie der Endstoffe (H2) mit der der Ausgangsstoffe (H1). Ist die Enthalpie der Endstoffe geringer als die der Ausgangsstoffe, so ergibt sich für DH ein negativer Wert. Es liegt eine exotherme Reaktion vor, sie setzt also Energie frei.
Reaktionsenthalpie DH = H2 – H1 < 0

© Belinda Flemming: Energiediagramm einer exothermen Reaktion, CC BY-SA
Bei endothermen Reaktionen, also solchen, bei denen Energie aufgenommen wird, sind die Verhältnisse entsprechend umgekehrt. Im Energiediagramm liegen die Endstoffe über den Ausgangsstoffen. Die Reaktionsenthalpie ist positiv: DH = H2 – H1 > 0
Auch hier kann Aktivierungsenergie erforderlich sein.

© Belinda Flemming: Energiediagramm einer endothermen Reaktion, CC BY-SA
z.B.: Die Ammoniaksynthese
Ammoniak (NH3) ist eine Chemikalie von grundlegender Bedeutung. Ammoniak wird zur Herstellung von Düngemitteln (80%), Salpetersäure, Sprengstoffen, Kunststoffen, pharmazeutischen Produkten und anderem benötigt. Seine Herstellung erfolgt aus Luftstickstoff und Wasserstoff:
N2 + 3 H2 → 2 NH3
Die Reaktivität des N2 ist jedoch wegen der Dreifachbindung im Molekül extrem gering. Anders ausgedrückt: Die Aktivierungsenergie ist sehr hoch. Die Synthese des Ammoniaks unter Laborbedingungen gelang Fritz Haber (1868 – 1934) unter Einsatz eines Katalysators.
z.B.: Weißer Phosphor
Neben rotem und violettem existiert der sehr giftige weiße Phosphor, der wegen seiner leichten Oxidierbarkeit unter Wasser aufbewahrt wird. Er besteht aus P4-Molekülen mit großer innerer Spannung. Die vier P-Atome sind im Molekül tetraedrisch angeordnet, bilden also die vier Ecken eines Tetraeders. Entlang den sechs Kanten des Tetraeders verlaufen Atombindungen. Die Bindungswinkel betragen daher 60°. Trägt man weißen Phosphor in fein verteilter Form auf Papier auf (dazu löst man Phosphor z.B. in Schwefelkohlenstoff und lässt das Lösungsmittel nach dem Auftragen verdunsten), so entzündet er sich innerhalb weniger Sekunden. Die Aktivierungsenergie ist hier offensichtlich gering:
P4 + 5 O2 → P4O10
Der Molbegriff
Will man die frei werdende Energie für eine bestimmte Reaktion angeben, so muss man sich auf eine bestimmte Stoffmenge beziehen.
Will man die Masse eines Mols eines Stoffes bestimmen, so setzt man hinter die Relative Atommasse eines Elements die Einheit Gramm. 1 mol Schwefel erhält man durch Abwiegen von 32 g Schwefel. 1 mol Gold (Au) besitzt eine Masse von 197 g. In 32 g Schwefel sind also genauso viele Schwefelatome, wie Goldatome in 197 g Gold enthalten sind, nämlich 6,022 . 1023 Stück. Bei Verbindungen addiert man die Relativen Atommassen. So besitzt 1 mol Wasser z.B. eine Masse von 18 g, 1 mol NaCl eine Masse von etwa 58,5 g. In einem mol NaCl sind demnach 6,022 . 1023 Na+-Ionen und 6,022 . 1023 Cl–-Ionen enthalten.
Die Bildungsenthalpie
Verbindungen entstehen durch Reaktion aus ihren Elementen. Diese Reaktionen können exotherm oder endotherm verlaufen. Beispiele sind Wasser oder Stickstoffmonoxid (siehe unten). Die auftretenden Enthalpiedifferenzen heißen Bildungsenthalpien.
Zur Bestimmung von Bildungsenthalpien müssen Standardbedingungen eingehalten werden. Dies sind T = 298 K und p = 1013 hPa.
So lässt sich etwa Wasser aus den Elementen Wasserstoff und Sauerstoff herstellen. Die Reaktion (auch als Knallgasreaktion bekannt) verläuft exotherm. Bei der Bildung von 1 mol flüssigem Wasser (also von 6,022 . 1023Wassermolekülen oder 18 g Wasser) werden 286 kJ frei.
H2 + 1/2 O2 → H2O DHm = – 286 kJ/mol
Die Reaktionsgleichung sollte also so formuliert werden, dass 1 mol Wasser entsteht. Formuliert man jedoch
2 H2 + O2 → 2 H2O DHm = 2(- 286) kJ/mol,
so verdoppelt sich die frei werdende Energiemenge.
Es gibt aber auch viele endotherm gebildete Verbindungen, z.B. Stickstoffmonoxid.
1/2 N2 + 1/2 O2 → NO DHm = + 90 kJ/mol
Technisch werden Bildungsenthalpien z.B. mit Hilfe einer kalorimetrischen Bombe ermittelt. Man setzt dabei eine Reaktion, z.B. die Verbrennung einer Substanz in reinem Sauerstoff, durch einen elektrischen Zünder in Gang. Aus der Masse der verbrannten Substanz, dem Wasservolumen und dem Temperaturanstieg lässt sich die frei gewordene Energie berechnen (Ausgewählte Bildungsenthalpien unter Standardbedingungen).
Die molare Reaktionsenthalpie
Bei der Verbrennung von Methan wird Reaktionsenthalpie frei:
CH4 + 2 O2 → CO2 + 2 H2O DHm = – 890 kJ/mol
Die angegebene Reaktionsenthalpie heißt molare Reaktionsenthalpie DHm und bezieht sich auf die in der Reaktionsgleichung angegebenen Stoffmengen, wobei die Koeffizienten als Stoffmengenangaben zu verstehen sind: Also 1 mol Methan reagiert mit 2 mol Sauerstoff zu 1 mol Kohlenstoffdioxid und 2 mol Wasser. Sind die Bildungsenthalpien der an einer beliebigen Reaktion beteiligten Verbindungen bekannt, so lässt sich auch die Reaktionsenthalpie dieser Reaktion nach folgender Formel errechnen:
Hm(CH4) = – 75 kJ/mol
Hm(O2) = 0 kJ/mol
Hm(CO2) = – 393 kJ/mol
Hm(H2O) = – 286 kJ/mol bezogen auf den flüssigen Aggregatszustand
DHm = – 393 kJ/mol + 2(- 286 kJ/mol) – (- 75 kJ/mol + 0 kJ/mol) = – 890 kJ/mol
Die Reaktionsenthalpie
Um die Reaktionsenthalpie für beliebige Massen an umgesetzten Stoffen berechnen zu können, muss die molare Reaktionsenthalpie DHm mit der Stoffmenge n multipliziert werden:
Für die Verbrennung von Ethanol ist die molare Reaktionsenthalpie bekannt:
2 C2H5OH (fl) + 6 O2 (g) → 4 CO2 (g) + 6 H2O (fl) DHm = – 2736 kJ/mol
Der angegebene Wert bezieht sich auf die Verbrennung von 2 mol Ethanol. Sollen 13 mol Ethanol verbrannt werden, so berechnet sich DH zu (13/2 mol) . (- 2736 kJ/mol) = – 17784 kJ. Die Reaktionsenthalpie erhält also die Einheit kJ. In der Praxis tritt häufig der Fall auf, dass Reaktionsenthalpien nicht für bestimmte Stoffmengen zu berechnen sind sondern für bestimmte Massen. Zur Umrechnung von Massen in Stoffmengen ist die molare Masse erforderlich. Hierauf soll an dieser Stelle nicht weiter eingegangen werden.
Ausgewählte Bildungsenthalpien unter Standardbedingungen
| Stoffname | Formel | Aggregats- zustand |
Hm in kJ/mol |
| Wasser | H2O | (fl) | – 286 |
| Wasser | H2O | (g) | – 242 |
| Kohlenstoffdioxid | CO2 | (g) | – 393 |
| Kohlenstoffmonoxid | CO | (g) | – 111 |
| Ammoniak | NH3 | (g) | – 46 |
| Stickstoffmonoxid | NO | (g) | + 90 |
| Stickstoffdioxid | NO2 | (g) | + 33 |
| Methan | CH4 | (g) | – 75 |
| Ethan | C2H6 | (g) | – 85 |
| Propan | C3H8 | (g) | – 104 |
| Octan | C8H18 | (fl) | – 250 |
| Ethanol | C2H5OH | (fl) | – 276 |
| Aluminiumoxid | Al2O3 | (f) | – 1676 |
| Eisenoxid | Fe2O3 | (f) | – 824 |

