2.2.3 Atommodell nach Bohr
Linienspektren
Bereits im 18. Jahrhundert war bekannt, dass bestimmte chemische Elemente beim Verbrennen charakteristische Flammenfärbungen erzeugten. Diese so hervorgerufenen Leuchterscheinungen wurden von Bunsen (1811 – 1899) und Kirchhoff (1824 – 1887) näher untersucht. Betrachtete man das Licht durch ein Spektroskop, dessen wichtigstes Bauteil ein Glasprisma war, so beobachtete man helle, farbige Linien. Ihre Anordnung in der Reihenfolge abnehmender Wellenlänge nennt man Linienspektrum.

By Alchemist-hp www.pse-mendelejew.de – Own work, CC BY-SA 3.0 de, Link
Intensiv untersucht wurden auch die Spektren von Wasserstoff, Deuterium, Stickstoff, Sauerstoff und Quecksilber (von links nach rechts). Diese lassen sich in einer Gasentladungsröhre durch Anlegen einer hohen Spannung zum Leuchten bringen.

© Belinda Flemming: Spektralserien des Wasserstoffatoms (links), Bereich der Spektralserien im Atom (rechts), CC BY-SA
Spektralserien des Wasserstoffatoms: Die Energieniveaus sind auf Bahn 1 bezogen. Energieniveaus und Übergänge können auch in einem Energieniveauschema dargestellt werden. Beim H-Atom sind Übergänge in Absorption und Emission von allen angeregten Zuständen ins Grundniveau und umgekehrt möglich.. Die Emissionsübergänge in gleiche Niveaus, z.B. in das 2. Niveau, führen zu den Spektralserien, z.B. der Balmerserie.

© Belinda Flemming: Linienspektrum von Wasserstoff, CC BY-SA
Die von Wasserstoff emittierte elektromagnetische Strahlung erstreckt sich außer auf den sichtbaren auch auf den infraroten und den ultravioletten Bereich des Spektrums. Die Linien treten dabei in Serien auf, die nach Forschern benannt wurden. Eine schlüssige Deutung dieser Spektrallinien gelang jedoch nicht ohne eine grundlegende Theorie des Atoms.
Das Schalenmodell nach Bohr
Die Schalen des Bohrschen Atommodells (bzw. die Energieniveaus) wurden von innen nach außen mit den Buchstaben K, L, M usw. oder mit ganzen Zahlen n = 1, 2, 3 usw. bezeichnet (n ist die Hauptquantenzahl).
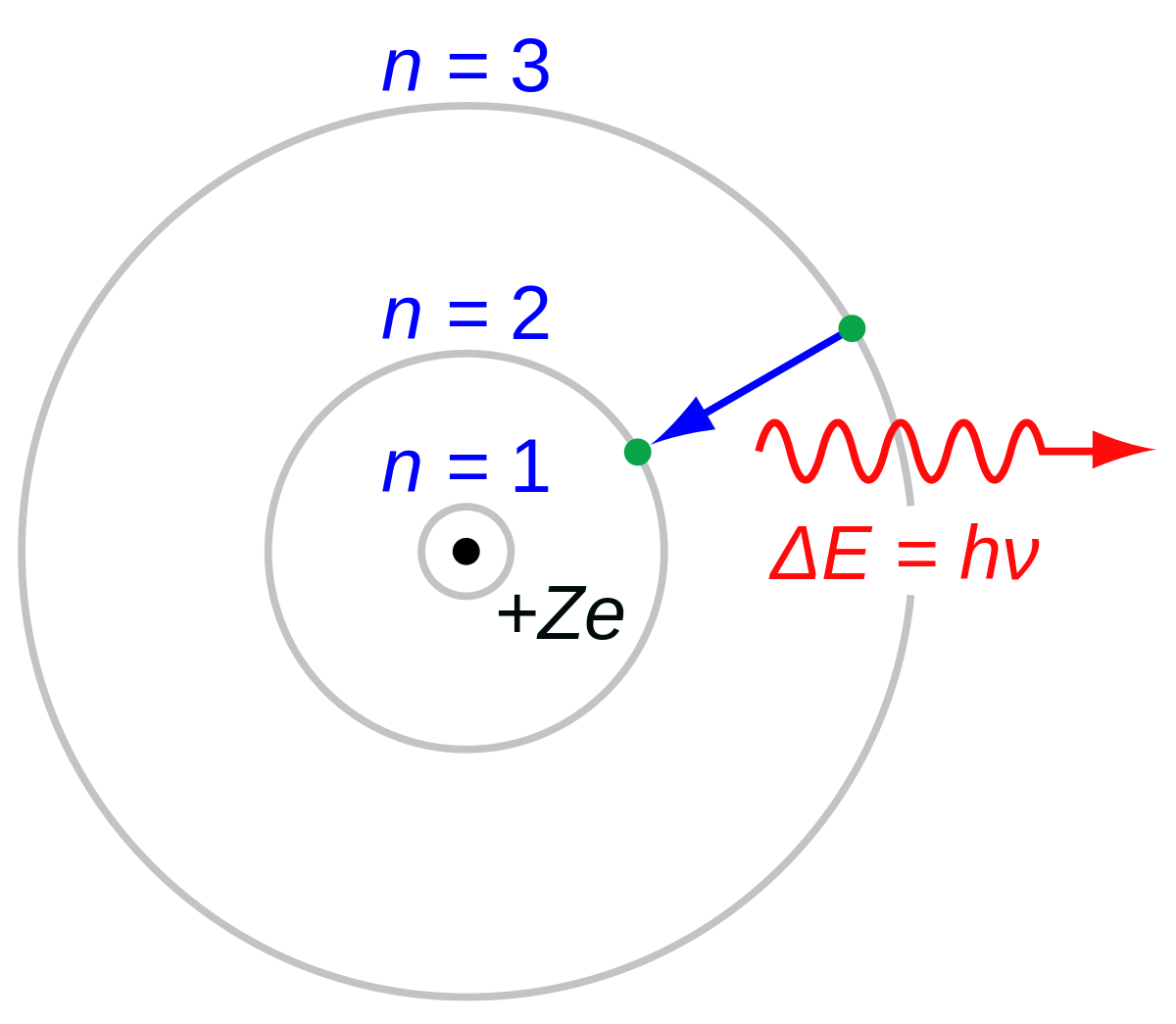
By JabberWok, CC BY-SA 3.0, Link
Nach dem Bohrschen Atommodell bewegen sich Elektronen auf Kreisbahnen bestimmter Energie. Hier wechselt ein einzelnes Elektron von der 3. auf die 2. Kreisbahn; es wird ein Photon entsprechender Frequenz ausgesendet.
Der Zusammenhang zwischen Energie, Frequenz und Wellenlänge des emittierten Lichts:
Die Formeln zeigen, dass die abgegebene Energie der Frequenz des abgestrahlten Lichts direkt proportional und seiner Wellenlänge indirekt proportional ist. Nimmt man die Balmerserie des Wasserstoffspektrums als Beispiel, so werden ihre Linien durch Elektronenübergänge von höheren Schalen (n > 2) auf die L-Schale (n = 2) verursacht. Alle Linien liegen im sichtbaren Bereich des Spektrums. Ein Elektronenübergang, der die violette Linie (434,0 nm) verursacht, setzt mehr Energie frei als ein Übergang, der die rote Linie (656,3 nm) verursacht. Die dunklen Bereiche zwischen den Linien bedeuten, dass es Übergänge, die solchen Wellenlängen entsprechen, nicht gibt. Anders ausgedrückt: Elektronen sind an bestimmte Schalen gebunden. Ein Aufenthalt zwischen den Schalen ist verboten. Entsprechende Energiezustände existieren nicht.
Bohrs Berechnungen trafen für Energiezustände der Elektronen im Wasserstoffatom zu. Bei komplizierteren Atomen jedoch scheiterte sein Ansatz.
