2.2.2 Atommodelle nach Thomson und Rutherford
Thomsons Atommodell
By Kurzon – Own work, CC BY-SA 4.0, Link
Dennoch gingen davon Impulse an junge Wissenschaftler wie den Thomson-Schüler Ernest Rutherford aus.
Rutherfords Atommodell
Nach der Entdeckung der Radioaktivität durch Henri Becquerel 1896 experimentierte der gebürtige Neuseeländer Ernest Rutherford (1871 – 1937) mit radioaktiven Stoffen, wie dem α-Strahler Radium-226. 1911 führte er Streuexperimente an Goldfolien durch und fand dabei heraus, dass positiv geladene α-Teilchen (identisch mit Heliumkernen = 2 Protonen und 2 Neutronen) eine extrem dünne Goldfolie nahezu ungehindert durchdrangen. Die α-Teilchen entstammten einer radioaktiven Substanz, die in einen Bleiblock eingeschlossen war. Die α-Teilchen konnten durch eine Bohrung nur in eine Richtung aus dem Bleiblock austreten. Ein fluoreszierender Schirm hinter der Folie zeigte das Auftreffen der α-Teilchen an.
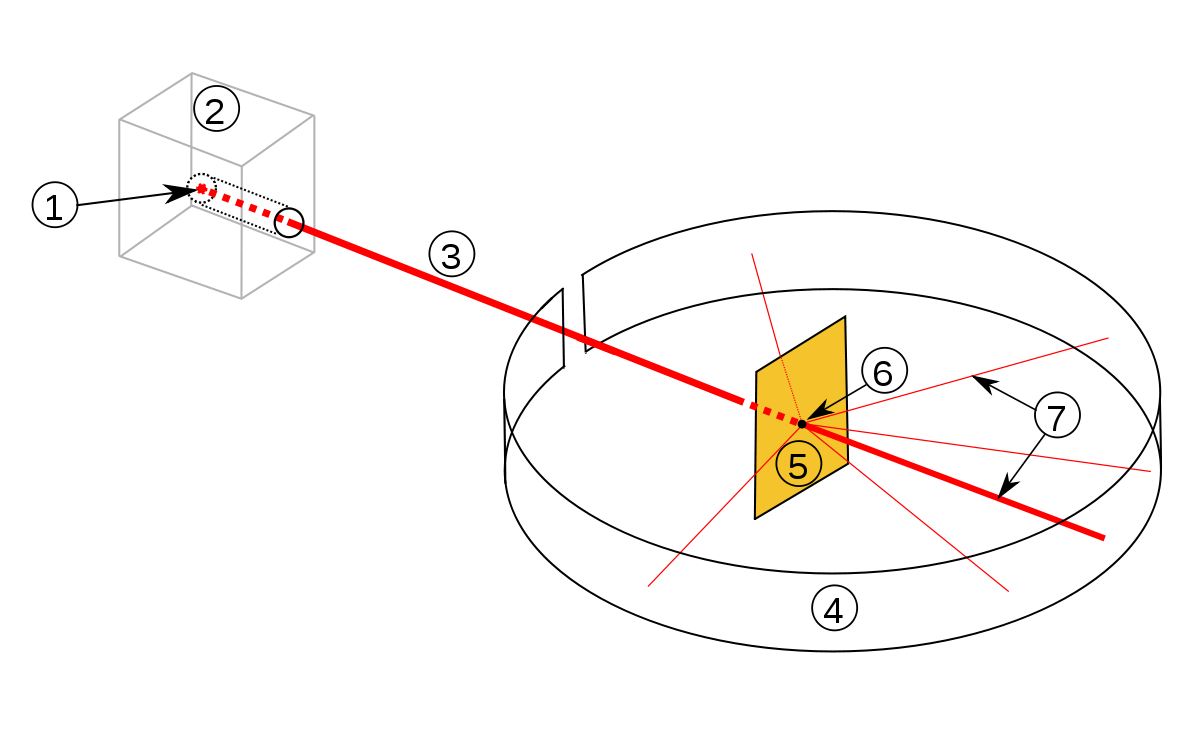
By Rutherfordscher_Streuversuch.svg: Sundance Raphael 15:22, 19. Dez. 2006 (CET). The original uploader was Sundance Raphael at German Wikibooks. derivative work: Fujnky (talk) – Rutherfordscher_Streuversuch.svg, Public Domain, Link
Streuversuch-Aufbau: 1: Radioaktives Radium, 2: Bleimantel zur Abschirmung, 3: Alpha-Teilchenstrahl, 4: Leuchtschirm bzw. Fotografieschirm 5: Goldfolie 6: Punkt, an dem die Strahlen auf die Folie treffen, 7: Teilchenstrahl trifft den Schirm, nur wenige Teilchen werden abgelenkt.

By Kurzon – Own work, CC BY-SA 3.0, Link
Linke Hälfte: Versuchsergebnis, wie es nach dem Thomson-Modell zu erwarten wäre. Rechte Hälfte: Erhaltenes Ergebnis und Veranschaulichung mit dem Rutherford-Modell.
Die Atomkerne können kaum maßstabsgetreu dargestellt werden. Ein halbwegs realistisches Modell, das die Winzigkeit von Atomkernen im Verhältnis zum Atomdurchmesser ausdrückt, erhält man, wenn man sich ein Fußballstadion von etwa 100 m Durchmesser vorstellt (Atom), wobei am Anstoßpunkt des Fußballfeldes eine Erbse liegt (Atomkern).
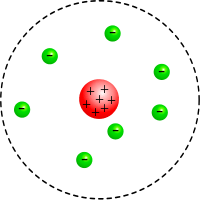
Die Atome besaßen demnach einen sehr kleinen, positiv geladenen, massereichen Kern, der von einer Hülle aus Elektronen umgeben war, die ihn in bestimmten Abständen umkreisten, wie Planeten die Sonne, so die Auffassung Rutherfords.
Aber auch dieses Modell besaß seine Schwächen. Denn die Physik lehrte, dass geladene Objekte auf Kreisbahnen Strahlung abgeben mussten. Damit sollten die Elektronen unter Energieverlust auf einer Spiralbahn in den Kern stürzen. Dies widersprach der Beobachtung einer doch sehr stabilen atomaren Welt.
