2.4 Proteine – Synthese und Funktionen
2.4.1 Genetischer Code
Grundlagen und Anwendung des genetischen Codes
Der Bauplan für die Proteine, die in einer Zelle hergestellt werden, wird aus der DNA abgelesen und in m-RNA umcodiert. Für bestimmte Basenfolgen der m-RNA existieren komplementäre Basenfolgen auf t-RNA-Molekülen, die bestimmte Aminosäuren tragen können. Durch Verknüpfung dieser Aminosäuren werden Proteine aufgebaut.
Folgende Sachverhalte sind für das Verständnis des Ablaufs der Proteinbiosynthese von größter Bedeutung:
- Ein Basentriplett (Codon, drei nebeneinander liegende Basen) verschlüsselt genau eine Aminosäure.
- Viele Aminosäuren werden durch mehrere Basentripletts codiert. Deshalb wird der genetische Code als degeneriert bezeichnet.
- Der Code ist kommafrei, d.h. es gibt keine Unterbrechung oder Markierung zwischen den einzelnen Codons.
- Der Code wird in 5´-3´-Richtung gelesen.
- Der Code ist weitgehend universell, d.h. für fast alle Lebewesen gültig
(Beweis für die Verwandtschaft aller (Beweis für die Verwandtschaft allerLebewesen).
By Mouagip (talk) This W3C-unspecified vector image was created with Adobe Illustrator. – Codons_aminoacids_table.png, Public Domain, Link
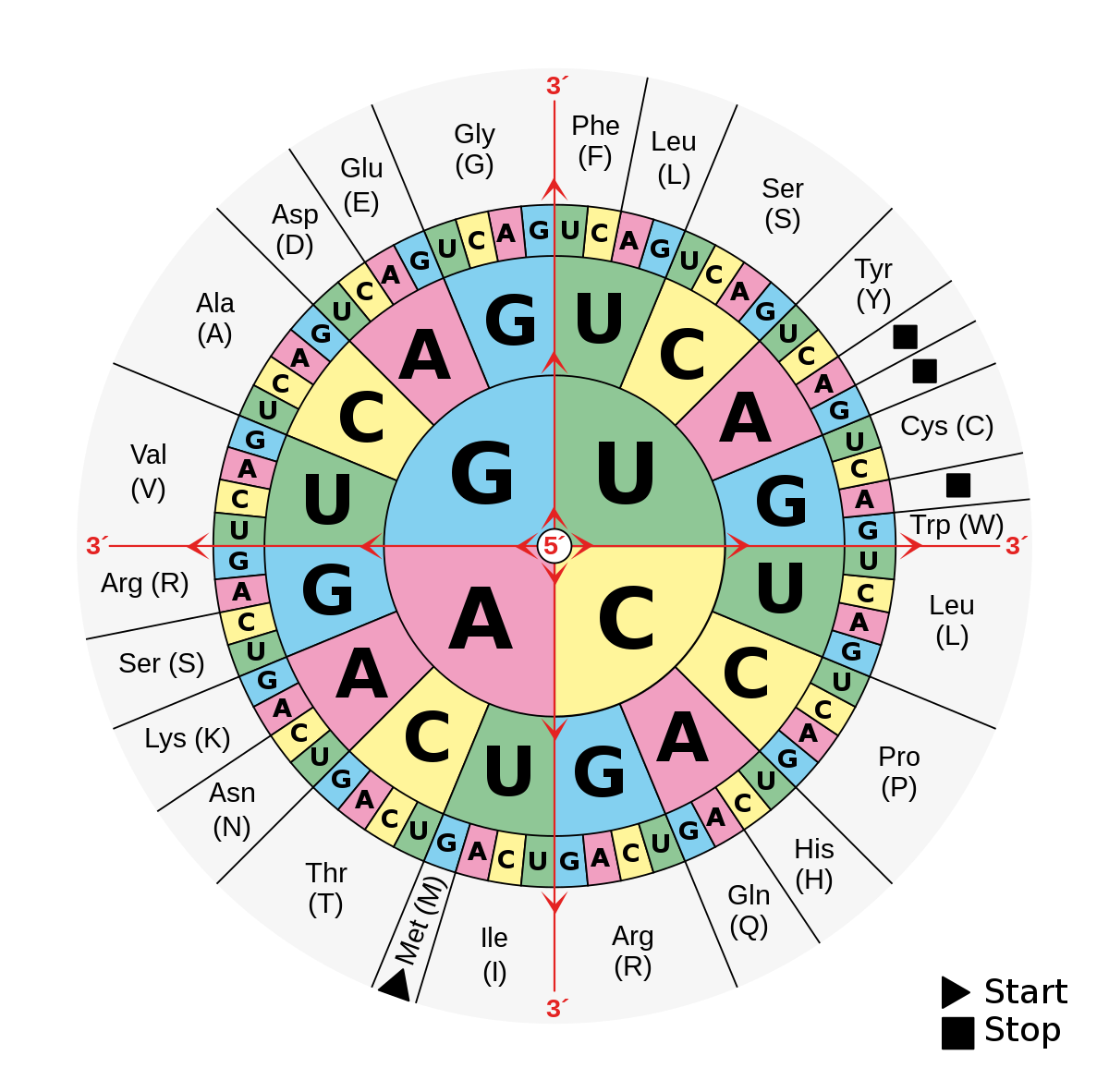
Code-Sonne (Code-Uhr) der m-RNA
Die Code-Sonne oder Code-Uhr dient als Hilfsmittel bei der Übersetzung einer m-RNA-Sequenz in eine Aminosäurenfolge. Sie wird von innen nach außen gelesen.

Alternativ kann man das Code-Lexikon zur Bestimmung einer Aminosäurenfolge aus einer m-RNA-Sequenz benutzen, indem aus der Reihenfolge des 1., 2. und 3. Nukleotids der Schnittbereich bestimmt wird.
Beispiel:
| Codogener Strang einer DNA: | ACCGCTAGCAATTTC |
| mit Trennstrich zur besseren Lesbarkeit: |
ACC|GCT|AGC|AAT|TTC |
| m-RNA-Molekül: | UGGCGAUCGUUAAAG |
| mit Trennstrich zur besseren Lesbarkeit: |
UGG|CGA|UCG|UUA|AAG |
| t-RNA-Moleküle: | ACC; GCU; AGC; AAU; UUC |
| Aminosäuresequenz eines Proteins: | Trp – Arg – Ser – Leu – Lys |
Abkürzungen der Aminosäuren:
| Ala | Alanin | Lys | Lysin |
| Arg | Arginin | Leu | Leucin |
| Asn | Asparagin | Met | Methionin |
| Asp | Aparaginsäure | Phe | Phenylalanin |
| Cys | Cystein | Pro | Prolin |
| Gln | Glutamin | Ser | Serin |
| Glu | Glutaminsäure | Thr | Threonin |
| Gly | Glycin | Trp | Tryptophan |
| His | Histidin | Tyr | Tyrosin |
| Ile | Isoleucin | Val | Valin |
Anmerkung:
Bei den sog. Retroviren (z.B. HIV-Virus) findet eine Umschreibung von RNA in DNA statt. Diese Viren enthalten als Erbgut nicht DNA sondern RNA. Die RNA wird nach dem Einbringen in die Wirtszelle von der ebenfalls vom Virus gelieferten reversen Transkriptase in DNA umgeschrieben.
2.4.2 Proteinbiosynthese:
1. Transkription
Ablauf der Transkription
Die Transkription ist der erste Schritt der Proteinbiosynthese, d.h. der Umsetzung von Erbinformation in Proteine (Eiweißstoffe).

Belinda Flemming: Transkription der DNA (1. Schritt der Proteinbiosynthese), CC BY-SA 3.0
Bei der Transkription wird im Zellkern die Basensequenz der DNA in eine m-RNA als Vorlage für die Synthese des Proteins umgesetzt. Der Prozess verläuft in folgenden Schritten:
- Die RNA-Polymerase lagert sich an den Promotor an. Dies ist eine spezielle, ca. 10 Basenpaare lange Sequenz der DNA.
- Der Doppelstrang wird durch die Polymerase geöffnet.
- Der codogene Strang wird erkannt. Es ist derjenige, der von 3´ nach 5´ verläuft.
- Anschließend erfolgt die Ablesung des codogenen Stranges und die Übersetzung in einen komplementären RNA-Strang, wobei Adenin (DNA) mit Uracil (RNA), Cytosin (DNA) mit Guanin (RNA), Guanin (DNA) mit Cytosin (RNA) und Thymin (DNA) mit Adenin (RNA) paart. Der m-RNA-Strang wächst in 5´-3´-Richtung. Die dazu nötigen Nukleotide sind im Kernplasma vorrätig.
2. Translation
Ablauf der Translation
Die Translation ist die Übersetzung der Basensequenz der m-RNA in eine Aminosäuresequenz eines Proteins. Der Vorgang findet im Zellplasma an den Ribosomen statt.

Belinda Flemming: Translation der m-RNA (2. Schritt der Proteinbiosynthese), CC BY-SA 3.0
Zunächst lagern sich mehrere Ribosomen (hier dunkelgrau) in Folge an der m-RNA an und wandern an ihr entlang. (Im Bild ist nur eines davon dargestellt.) Durch t-RNA-Moleküle (im Bild rechts unten) werden die zu verknüpfenden Aminosäuren zur Verfügung gestellt. Diese t-RNA-Moleküle bestehen aus einem RNA-Einzelstrang mit ca. 80 Nukleotiden, der zu einer kleeblattähnlichen Struktur geformt ist. An einem Ende der Struktur ist eine bestimmte Aminosäure gebunden (hier Prolin). Am gegenüberliegenden Ende befindet sich das zugehörige Anticodon (hier GGA). Dieses Anticodon kann jetzt am entsprechenden Codon der m-RNA (hier Codon Nr. 8, CCU) binden. Anschließend erfolgt die Verknüpfung der Aminosäuren. Das vorausgehende Lysin wird mit dem Prolin verknüpft. Danach schiebt sich das Ribosom ein Triplett weiter. Dadurch wird eine t-RNA frei, hier diejenige mit dem Anticodon GUU. Die frei gewordenen t-RNA-Moleküle verbinden sich wieder mit einer entsprechenden Aminosäure und werden erneut in den Prozess eingeschleust. Der Vorgang wiederholt sich so lange, bis auf der m-RNA ein Stopp-Codon erreicht ist. Das gebildete Protein löst sich nun vom m-RNA-Strang ab und nimmt selbständig die durch die Aminosäuresequenz vorgegebene Raumstruktur ein. Es ist dann funktionsfähig.
2.4.3 Bau und Bedeutung der Proteine und Enzyme für den menschlichen Körper
Proteine werden bei Verdauung in ihre Bausteine – Aminosäuren (AS) – zerlegt
↓
AS gelangen mit Blutstrom in die Zellen
↓
Aufbau körpereigener Proteine durch Neukombination der 20 verschiedenen AS durch kettenartige Verknüpfung von bis über 1000 AS in bestimmter Reihenfolge (Sequenz)
Die Information für die Bauanleitung der AS-Sequenz wird der Sequenz der Bausteine der DNA entnommen!
Bau der Proteine:
- Aminosäuren als Bausteine
- 20 AS, davon 8 essentiell (= können nicht vom Körper hergestellt werden, müssen mit der Nahrung aufgenommen werden)
- es existieren zehntausende verschiedene, körpereigene Arten von Proteinen im menschlichen Körper
- sie besitzen eine komplexe, dreidimensionale Struktur = Quartärstruktur (Anziehungskräfte inner-halb des Riesenmoleküls und zu Nachbarmolekülen)
- faserartige oder globuläre Struktur
- Struktur des Proteins (abhängig von AS-Sequenz) bestimmt seine Funktion (Schlüssel – Schloss – Prinzip, d.h. das Protein ist an seiner Wirkstelle für eine bestimmte Reaktion verantwortlich)
Austausch von nur einer AS verändert Schlüsselform!

Die vier Ebenen der Proteinstruktur, von links nach rechts: Primärstruktur (Kette aus Aminosäuren), Sekundärstruktur (β-Faltblatt links, α-Helix rechts), Tertiär- und Quartärstruktur.
Beispiel: Trockenmasse roter Blutkörperchen zu 90% aus Hämoglobin (roter Blutfarbstoff – aus Proteinen u. eisenhaltigen Hämgruppen (transportieren O2))
↓
rote scheibenförmige Blutkörperchen
↓
Austausch 1 AS im Hämoglobin gegen eine Andere
↓
Formänderung des Hämoglobins
↓
sichelförmige rote Blutkörperchen
= Sichelzellanämie (Erbkrankheit, Problem: Verstopfung winziger Blutgefäße, Behinderung des Blutflusses in größeren Gefäßen, Folge: geringere Sauerstoffversorgung)
Bedeutung der Proteine:
- unentbehrlich für Stoffwechselreaktionen in der Zelle
- ermöglichen Muskelkontraktion und Verdauung von Nährstoffen
- Hormone sind Proteine – die Wachstum, Entwicklung oder Blutzuckerspiegel kontrollieren
- Bindeglied zw. Erbanlagen (Genotyp) und Erscheinungsbild (Phänotyp) von Lebewesen
bestimmen die Ausprägung der Merkmale im Organismus (Strukturproteine zum Aufbau des Organismus, Enzymproteine zur Steuerung von Zellreaktionen)

Belinda Flemming: Bedeutung der Proteine für den menschlichen Körper, CC BY-SA 3.0
Beispiele für faserartige Proteine (lineare Gestalt):
- Kollagen (unlösliche, zugfeste und elastische Faser; beteiligt am Aufbau von Knochen, Haut, Sehnen und Knorpeln)
- Keratin (verantwortlich für Stabilität und Form der Zellen; Hauptbestandteil der Haare und Nägel)
- Fibrinogen (Bestandteil des Blutplasmas, bewirkt Blutgerinnung)
- Muskelproteine Aktin u. Myosin (ermöglichen Bewegung)
Beispiel für globuläre Proteine (kugelförmige Gestalt):
- Enzyme (katalysieren chemische Reaktionen im Körper, z.B. Verdauung – α-Amylase spaltet Stärke in Maltose)
- Antikörper im Blut (Immunabwehr – machen Krankheitserreger unschädlich)
- Hormonproteine (chemische Botenstoffe zur Infovermittlung)
- Proteine bei denen die biologische Funktion durch Bindung eines Nichtproteinanteils bestimmt wird (Sehfarbstoff Rhodopsin in Stäbchen zerfällt bei Belichtung wodurch Signalkette zum Gehirn ausgelöst wird; Hämoglobin transportiert Sauerstoff)
